实验外包——你必看的免疫组化实验攻略:检测结果阴性,非特异性染色,染色强度不够,着色不均,脱片,干片问题解决
发布时间:2025-09-10
浏览次数:9289
作者:东极药物
免疫组化实验过程包括切片制作(固定,脱水,透明,包埋,切片,贴片,烤片),脱蜡,水化,阻断,抗原修复,封闭,一抗孵育,二抗孵育,显色,复染,封片,分析。实验过程常见问题如检测结果阴性,非特异性染色,染···
免疫组化实验过程包括切片制作(固定,脱水,透明,包埋,切片,贴片,烤片),脱蜡,水化,阻断,抗原修复,封闭,一抗孵育,二抗孵育,显色,复染,封片,分析。
实验过程常见问题如检测结果阴性,非特异性染色,染色强度不够,着色不均,脱片,干片等,以下总结了所有可能会遇到的问题并且给出了对应的解决方法。
1.标本的固定
固定不及时或固定不完全,导致细胞核模糊,对比不鲜明。
优化建议:
组织离体后尽快固定,组织块大小为15×15×5mm,切开固定效果好;
固定液以10%中性福尔马林缓冲液为佳;
固定时间在4h-48h之间,长时间固定会影响抗原决定簇的暴露,产生阴性结果;
固定液的量要超过组织体积5倍以上。
2.标本的取材,脱水,浸蜡
如果组织脱水、浸蜡不充分,蜡块会出现组织收缩凹陷,而且在免疫组化热抗原修复操作时会容易脱片。
优化建议:
梯度酒精脱水尽量彻底充分;
二甲苯透明时间不宜长,1~3h为佳,透明过度会导致组织发硬发脆;
浸蜡应选择低熔点的石蜡,浸蜡应充分。
3.标本的切片,捞片,烤片
1)切片太厚导致有刀痕,有褶皱,脱片。
优化建议:
切片厚度视组织而定,如同淋巴结、肾等需要比较薄(不超过3um),脑组织需要较厚(尤其是取新鲜标本冰冻制片时),常规都要6-8um最佳,冰冻可切至10um;其他一般如胃肠道、肝胆等等组织,2-4um均可,太厚易掉片,细胞重叠,影响观察。
切片角度和刀片新旧程度对切片效果的影响较大,切片角度视切片机型号而异;新刀片容易切出完好的切片。
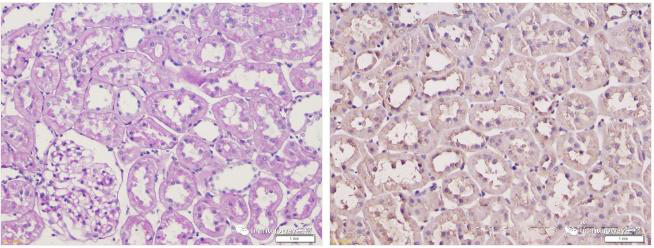
2)左:乳腺癌组织石蜡切片,Mammaglobin染色阳性,脱片,烤片时间不足。右:乳腺癌组织石蜡切片,MUC6染色阴性,烤片时间充分。
优化建议:
捞片要求达到无皱折、无气泡,水温宜在40℃左右。
粘片时需准备蛋白甘油,蛋白甘油由鸡蛋蛋清和甘油配而成,比例为1:1。 先将一滴蛋白甘油涂抹在干净的载玻片上,然后用载玻片从水中将展好的蜡片捞起,平放入烘箱内进行烘干。或者玻片用防脱片或多聚赖氨酸处理,以增强粘附性。
烘干温度为50℃,时间为12~24h。
4.标本的脱蜡不完全
3)脱蜡不全,组织出现异染现象,异染现象一般是苏木素着色不佳,HE染色没有选择性,染色不均匀。有的是伊红染不上。
建议:
根据不同的室温,调节脱蜡的时间,原则上是要彻底、干净、完全地脱去切片上的蜡。
4.抗原修复
相同组织,不同PH抗原修复液修复结果不一样。没有一种抗原修复缓冲液可以适用于所有抗原。
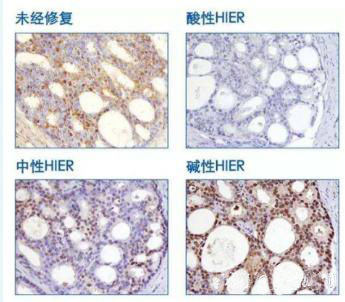
5.封闭
封闭时间过长,会导致阳性信号减弱甚至出现假阴性。封闭时间不足,会导致背景增强甚至出现假阳性。
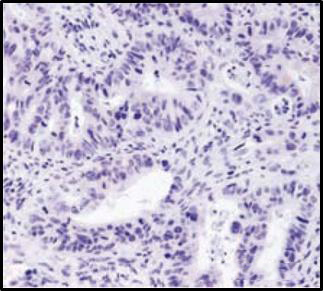
优化建议:
根据实验实际情况选择合适的封闭试剂和封闭时间。
6.洗涤
染色液的堆积(黑色箭头区域)。
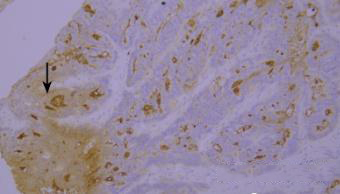
优化建议:
充分洗涤。
7.干片
干片导致的假阴性(黑色箭头区域)。
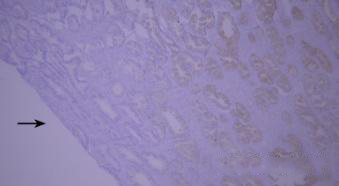
优化建议:
加入Tween-20的缓冲液能够更好地防止切片干燥。
8.边缘效应
边缘效应造成的非特异性染色(黑色箭头区域)。
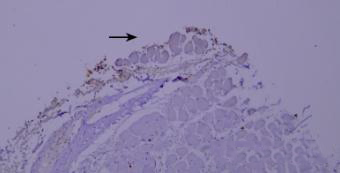
优化建议:
组织切片与玻片黏贴牢固,试剂完全覆盖组织防止干片,加入Tween-20的缓冲液能够更好地防止边缘效应。
9.一抗的选择
1)抗体特异性
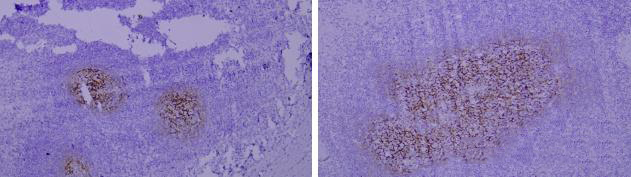
左:癌细胞胞浆强阳性,抗体细胞特异性及细胞亚定位染色正确。 右:癌细胞胞膜弱阳性,抗体细胞特异性正确,细胞亚定位错误,该抗体特异性不准确。
抗体特异性差,定位不准确。
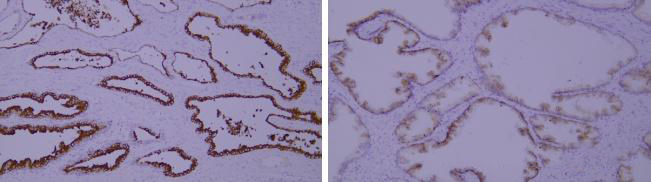
优化建议:
抗体的特异性是选择抗体最重要的原则,不同抗体特异性不同,组织特异性,细胞特异性,细胞亚定位的特异性需都准确。
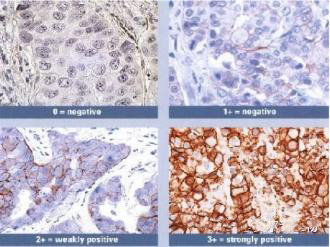
2)抗体的染色强度
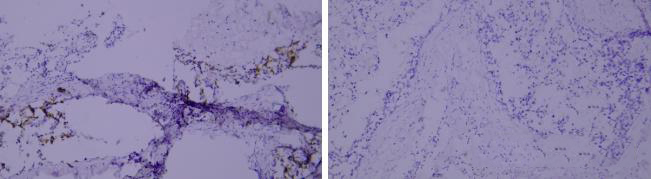
左:癌细胞染色胞膜强阳性。 右:癌细胞染色胞膜弱阳性,抗体染色强度不够。
检测结果会出现弱阳性。
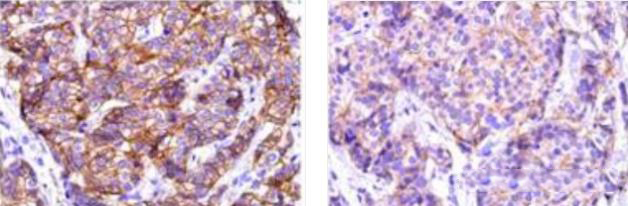
优化建议:
适当调整抗体稀释比,或者选择染色强度高,高亲和力的抗体。
3)抗体稀释比的影响
左:抗体1:8000稀释,略有背景。 右:调整抗体稀释比例1:30000,背景情况有所改善,抗原染色强度也有所降低。
染色结果出现非特异性染色或者是低背景。
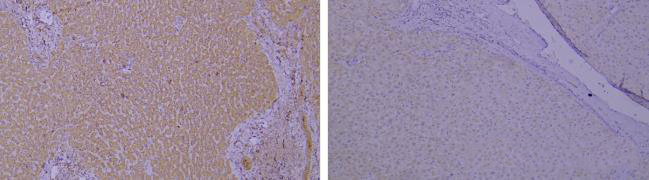
优化建议:
当结果出现非特异性染色或者有背景时,可以适当调整一抗的稀释比例进行改善。
4)一抗孵育条件
左:一抗4°C过夜,癌细胞胞浆强阳性,背景干净。
右:一抗37°C-60min,癌细胞胞浆中等强度阳性,背景干净。
孵育条件对染色结果有影响。
优化建议:
选择合适的一抗孵育条件。
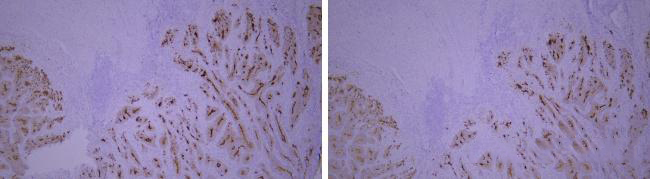
5)不同组织的影响
HER-2在4个不同乳腺癌的组织标本上的染色结果不同
染色结果与预期不符,检测阴性或者弱阳性。
优化建议:
设置阳性组织切片的对照,因为同一蛋白在不同组织中的表达会有很大的差异。
10.二抗选择
左:二抗为HRP直标二抗显色,染色结果弱阳性,低背景。
右:多聚物酶标记二抗显色,染色结果强阳性,背景干净,对比明显。
使用不同的二抗显色系统会出现不同的结果,可能会有弱阳性结果。
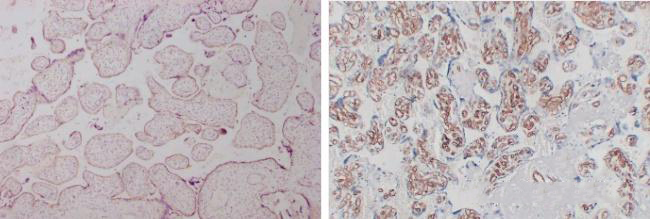
优化建议:
使用多聚物酶标记二抗比普通的HRP直标二抗灵敏度更高,背景更干净,对比更明显。
11.DAB显色
1)DAB絮状或团状沉积,产生深棕至黑色的DAB絮状或团状沉积于组织切片上。
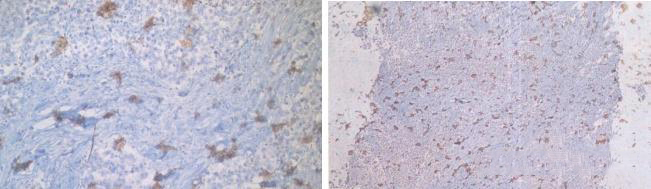
优化建议:
现配现用:因为DAB显色液配置好了之后极容易产生DAB的沉积,从而导致样本上会出现深棕色的絮状沉淀,干扰结果的判定。
显色时间:所有说明书上的显色时间均为一个范围,有的反应迅速的30s-3min,有的反应缓慢的3-20min,应该灵活调整,最好是滴加了DAB显色液后置于显微镜下控制显色时间。
信号偏弱
2)信号偏弱。
优化建议:
适当延长显色时间,滴加了DAB显色液后置于显微镜下控制显色时间。
12.苏木素使用原则
不同的苏木素配方的染色时间各有不同,配置的新旧程度染色时间也不同。
国际上常用的为Harris苏木素,因为配方中含汞,通常还需要进行分化,返蓝的步骤,但颜色亮丽。
改良的Mayer苏木素配方不需要分化,时间可以根据配置的时间调整染色时间15s-2min。
文章出自:验外实包 想了解更多请关注:http://www.dj-cro.com/